診療研究案内 消化器領域 肝臓グループ

消化器領域 肝臓グループ
スタッフ
| 教授: | |
| 教官: | 馬渡誠一(講師、医局長)、熊谷公太郎(助教、外来医長)、小田耕平(特任助教、肝疾患相談センター、病棟医長)、椨 一晃(特任助教、地域医療・健康医学講座)坂江 遥(特任助教、総合臨床研修センター) |
| 医員: | 豊留亜衣、庄 彬亘、近藤陽香、大西容雅、椨恵理子 |
グループの特色
肝臓グループは当教室が第二内科として開講した当初は第四研究室と言われ、第二内科を創設された佐藤八郎初代教授のもと、橋本修治二代目教授による肝臓病の研究に始まる歴史のある研究室グループです。その後、有馬輝勝三代目教授、坪内博仁四代目教授の肝臓病研究に大きく貢献しました。最近では、坪内博仁四代目教授が研究代表者を務めた厚生労働省の難治性肝・胆道疾患に関する調査研究班の研究にも携わりました。また、現在の井戸章雄五代目教授の下、肝疾患の診療及び研究に従事しています。
C型肝炎ウイルスが発見されるとともに、肝臓病の研究および診療は大きく変化しました。また、B型肝炎ウイルス感染者に対する核酸アナログ製剤を用いた治療やC型肝炎ウイルス感染者に対するインターフェロンや抗ウイルス剤を用いた治療は日々進歩しており、私たちは最新の治療を患者さんに提供できるように努めています。さらに、高齢化とともに肝癌患者さんも多く、その大半は肝炎ウイルスによるものとなっていますが、肝臓癌に対する最新IVR-CTを用いた診断、経カテーテル的治療、ラジオ波焼灼術などを積極的に行い、可能な症例は肝癌根治術後の抗ウイルス療法も積極的に行っています。また、最近は非アルコール性脂肪性肝疾患患者や、非B非C型の肝癌患者が増加傾向であり、診療だけではなく、研究面でもその治療と対策法の確立のために力を注いでいます。
当教室はグループ診療を積極的に進めており、肝臓グループも毎日のグループ回診、毎週の症例検討会および勉強会を積極的に行っています。また、消化器外科や放射線科、病理部と合同での症例検討会を行い、より良い集学的治療のための意見交換を行っています。
急性肝炎・劇症肝炎
急性肝疾患のうち、特に劇症肝炎は前教授の坪内博仁先生の時代から、当教室の主要な研究テーマであり、現在は寄附講座の「HGF組織修復・再生医療学講座」とともに新規治療法の開発に取り組んでいます。
劇症肝炎は、今のところ非常に予後の悪い疾患であり、肝移植以外に生命予後の改善に寄与する治療法は確立されていませんが、近年、人工肝補助療法の進歩により、患者さんの状態や意識レベルを保ったまま肝移植を待つことが可能になっています。当教室でも集中治療部や救急部の協力で、
HDFを用いた人工肝補助療法を導入し、高い覚醒率で患者管理を行っています。また、病院の屋上へリポートの運用も始まり、これまで以上に患者さんの受け入れがスムーズになりました。急性肝炎、急性肝不全(劇症肝炎)などの診療でお困りの際は、積極的に対応させていただきますので、いつでもご相談下さい。
慢性肝炎に対する診療
ウイルス性慢性肝炎(B型肝炎、C型肝炎)に対する治療は、ここ数年でめまぐるしい進歩を遂げています。C型肝炎に対しては、2011年11月に従来のペグインターフェロン(PEG-IFN)とリバビリン(RBV)併用療法に加えて、HCV NS3-4Aプロテアーゼ阻害剤(テラプレビル)による3剤併用療法が認可され、1型高ウイルス量といういわゆる難治例においても、約80%の患者さんでウイルス消失が得られるようになりました。2013年9月には第二世代のHCV NS3-4Aプロテアーゼ阻害剤であるシメプレビルも認可され、シメプレビル3剤併用療法は従来のPEG-IFN+RBV併用療法と副作用は変わらず、テラプレビル3剤併用療法と同等の治療成績です。さらに、2014年7月にIFNを使用しないNS5A阻害剤のダクラタスビル(DCV)とNS3-4Aプロテアーゼ阻害剤のアスナプレビル(ASV)併用療法が認可されました。IFNを含む治療に不適格の未治療例やIFNを含む治療に不耐容例、前治療無効例に対して適応となり、臨床試験ではウイルス消失率が80%を超え、高い治療効果が期待されています。また、副作用発現率が低く、安全性も高いと考えられています。当科では上記のすべての薬剤の治験に参加し、また、現在もC型慢性肝炎に対して幾つかの治験が進行中です。
一方、B型慢性肝疾患に対して、2006年7月にエンテカビルが承認され、ウイルス複製の高い抑制効果、ALTの改善効果、さらに肝組織像の改善効果が確認されています。2011年9月にはペグインターフェロンの48週間投与、2014年3月には新しい核酸アナログ製剤テノホビルが承認されており、B型肝炎に対する治療の選択肢も増えてきております。
以上のように、当科では最新の知見に基づいて、最良の治療法を提供できるように努めております。ウイルス性肝炎のみならず、自己免疫性肝疾患や非アルコール性脂肪性肝疾患の診断、治療も積極的に行っております。
肝癌に対する診療
本邦における肝細胞癌の現状
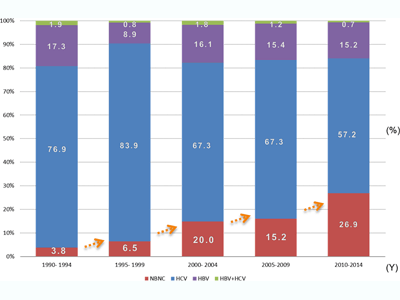
本邦における死亡原因の1位は悪性新生物で、総死亡者数は約36万人です。このうち肝癌による死亡者数は約3万人(男性が約2万人、女性が約1万人)で、がん全体の第4位を占めます。肝癌の原因としては、C型肝炎ウイルスによる慢性肝炎・肝硬変が約70%を占めていましたが、最近では肥満や脂肪肝など生活習慣病に関連した、非アルコール性脂肪性肝疾患などの非ウイルス性の慢性肝疾患が増加し、問題となっています(下図.当院における肝癌患者の原因の内訳)。
当科における肝癌の診療
当科では、肝癌に対して「診断」から「治療」まで、幅広く診療しています。外来では慢性肝炎・肝硬変の患者さんを含めて、年間約4,000件の腹部超音波検査を全例肝臓内科医が行っています。入院した患者さんに対しては造影超音波による精密検査を行い、造影CT/MRIと合わせてより正確な診断を心がけています。
新しい肝癌治療の導入
肝癌に対する「治療」は、患者さんの状態によりさまざまですが、当科ではどの病期の患者さんに対しても適切な治療が行える体制が整っています。現在まで当院で治療された初回登録患者さんは約700名にのぼります。
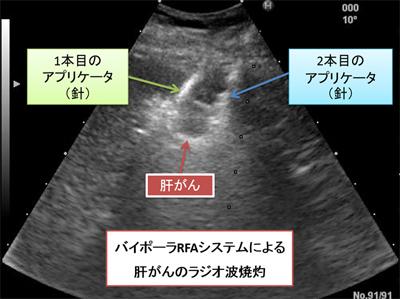
当科では新たな治療法も積極的に取り入れています。肝癌に対する経皮的ラジオ波焼灼術(RFA)として、2012年12月にバイポーラRFAシステム(CelonPOWER®、オリンパス社製)が保険適応となり、当院でも導入しています。バイポーラRFAシステムは、複数針でRFAを行いますが、肝癌を直接穿刺することなく焼灼が可能で、これまで手術に頼っていた肝表面や脈管に近接する肝癌に対しても有効です(下図)。
また、カテーテル治療として肝動注化学塞栓療法を行っていますが、2014年1月から新たな塞栓物質として、薬剤溶出性球状塞栓物質(drug-eluting bead;DEB)が使用可能となりました。DEBは抗がん剤を含浸(しみ込ませる)させる事で(下図)、抗がん剤の徐放作用が期待でき、かつ塞栓効果も期待できる事から現在注目されています。

さらに現在「放射線治療」として定位放射線療法(Stereotactic Radiotherapy;SRT)も導入し、RFAが困難な部位に存在する肝癌に対する局所療法として非常に有用であることが確認されつつあります。 鹿児島大学病院消化器内科では、従来の治療のみならず新規治療法も積極的に取り入れ、うまく組み合わせる事で、肝癌に対する幅広い治療選択が可能です。これからも患者さんにとってより良い治療方法を提案して行きます。
肝疾患研究
肝細胞増殖因子(HGF)
HGFはラットの肝幹細胞と考えられているOval cellの増殖と肝細胞への分化を促進することを明らかにし、大腸粘膜のc-Metリン酸化、上皮細胞のDNA合成活性促進を介したHGFの大腸粘膜修復作用も明らかにしています。また、HGFの効果およびその作用機序を、DNAマイクロアレイによるmRNAの網羅的解析などを用いて検討し、HGFによる肝発生・分化制御機序解明に基づく肝再生医療基盤技術創出研究に携わっています。
肝癌患者血清を用いたプロテオーム解析研究
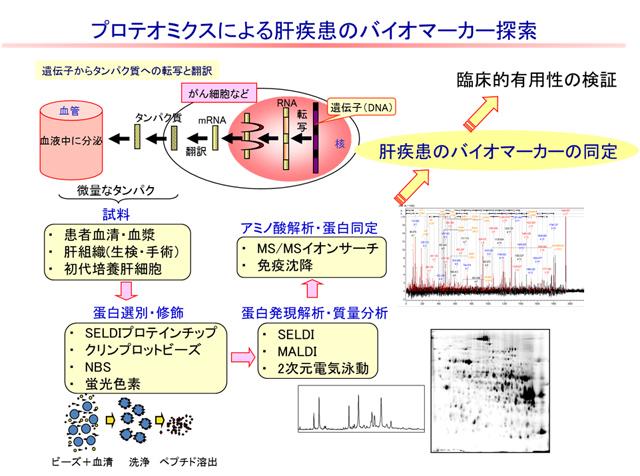
私たちはプロテオーム解析法を研究に導入し、患者さんから簡便に得られる血清を用いて、バイオマーカー探索を継続しています(図)。
この研究は、科学技術振興機構の支援で行われた、地域結集型共同研究事業の一環として開始され、この事業は2008年12月で終了しましたが、その後も研究を継続しています。今までの研究で、SELDIプロテインチップシステムを用いて、C型肝炎ウイルス(HCV)関連肝癌(HCV-HCC)患者および非肝癌患者血清のプロテオーム解析を行い、肝癌患者と非肝癌患者で有意差のある蛋白ピークを見出し、肝癌の早期診断法を報告しました。また、補体C3由来の断片が肝癌治療の評価に有用である可能性を報告しました。現在、肝硬変や肝癌のバイオマーカー探索研究を継続しています。
非アルコール性脂肪性肝疾患(NAFLD)研究
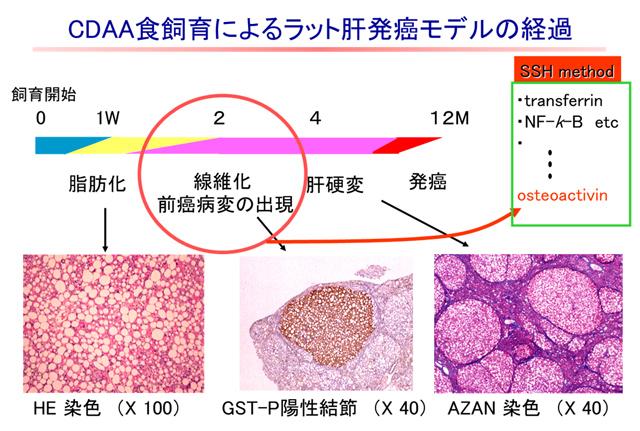
非アルコール性脂肪性肝疾患(NAFLD)について疫学研究および基礎的研究を進めています。NAFLD患者血清を用いて、タンパク質のプロテオミクスを行い、健常者と比べNAFLD患者で増加する蛋白をいくつか同定しています。例えば、NAFLD患者ではキニノゲンの440~456番目のペプチド断片が著しく増加することを見出し、このペプチド断片を特異的に認識する抗体を作製し、NAFLD診断キットの実用化に向けての検討を行っています。また、NAFLDで増加するタンパク質ピークの中には、非アルコール性脂肪肝炎(NASH)と非アルコール性脂肪肝(NAFL)を判別できる可能性のある候補タンパク質・ペプチドピークも存在することから、今後これらのタンパク質・ペプチドを同定し、NASH特異的なバイオマーカーを同定したいと考えています。さらに、動物モデルを用いた基礎的研究もプロテオーム解析と並行して行っています。非アルコール性脂肪肝炎のモデル動物であるコリン欠乏アミノ酸置換食飼育ラットでの解析では(図)、肝線維化ならびに前癌病変であるGST-P陽性結節が認められる時期に肝組織中のオステオアクチビン(OA)レベルが上昇することを報告し、またOAを肝特異的に発現させたトランスジェニックラットでは、肝線維化が有意に抑制されることも見出しています。さらに、ペルオキシソーム増殖剤活性化受容体(PPAR)は肝の脂肪酸代謝を制御している核内受容体の一つであり、PPARγアゴニストであるPioglitazoneがCDAA食飼育ラットの脂肪肝および肝線維化を抑制することも明らかにしています。現在は、脂肪肝および肝発癌モデルとして注目されているSTAMマウスに注目し、脂肪肝から肝発癌する機序の検討も行っています。
C型肝炎ウイルス高感染地区のコホート研究
C型肝炎の住民レベルでの自然経過は十分明らかになっていなかったため、20年以上前からからC型肝炎ウイルス高感染地区住民検診を行い、その後の疫学研究を他施設と共同研究しています。生命予後などの疫学調査から、HLA、一塩基多型解析などの遺伝子研究、さらに血清を用いたプロテオーム解析を行っています。例えば、IL28B遺伝子多型はC型慢性患者に対するインターフェロン治療効果に影響しますが(肝細胞研究会ホームページhttp://hepato.umin.jp/hottopics/hottopics005.html参照)、私たちは経過中にC型肝炎ウイルスが自然消失する症例にもこの一塩基多型が関与していることを報告しています。
このように、肝疾患を中心に常に臨床的問題点に焦点を当て、疫学研究から遺伝子解析、さらにはゲノミクスとプロテオミクスを導入した研究を進め、臨床への還元を目指しています。

